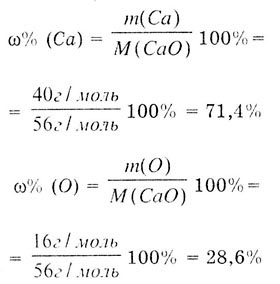
Закон постоянства состава, также известный как закон постоянных пропорций или закон Лавуазье, является одной из основных основ химии. Согласно этому закону, состав вещества остается неизменным независимо от источника или метода его получения.
Закон постоянства состава основан на следующем принципе: все вещества состоят из атомов различных химических элементов, и эти атомы соединяются в определенных пропорциях. Например, вода всегда состоит из двух атомов водорода и одного атома кислорода, независимо от источника этой воды.
Этот закон был первоначально сформулирован французским химиком Антуаном Лавуазье в 1789 году. Он проводил серию экспериментов, в результате которых установил, что во время химической реакции масса вещества сохраняется без изменений. Это означает, что сумма масс реагентов должна быть равна сумме масс продуктов реакции.
Закон постоянства состава в химии
Этот закон был сформулирован Жозефом Прюстом в конце XVIII века и подтвержден множеством экспериментальных данных. Он играет ключевую роль в химических расчетах, предсказании реакций и определении количества веществ.
Закон постоянства состава применяется в широком спектре химических реакций, включая образование соединений, синтез и разложение веществ, окислительно-восстановительные реакции и другие.
В рамках этого закона считается, что в каждом соединении компоненты, называемые элементами, объединены в фиксированных пропорциях по массе. Изменение условий реакции не влияет на пропорции, в которых элементы соединены.
Например, воду (H2O) всегда можно представить как соединение из двух атомов водорода и одного атома кислорода. Независимо от того, какое количество воды образуется или реагирует, пропорция атомов остается 2:1.
Закон постоянства состава обеспечивает устойчивость и константность химических соединений, позволяет проводить точные расчеты и определять количество веществ, участвующих в реакции.
Важно отметить, что закон постоянства состава является одним из основных принципов химии и обеспечивает основу для понимания и изучения химических реакций и соединений.
Основные принципы закона постоянства состава
Основные принципы закона постоянства состава можно сформулировать следующим образом:
- Масса вещества сохраняется в течение химической реакции.
- Масса продукта реакции равна сумме масс реагентов.
- Атомы не создаются или не уничтожаются во время химической реакции, они просто перераспределяются.
Закон постоянства состава применим к любым химическим реакциям, независимо от их сложности. Этот закон проверяется и подтверждается в экспериментах, и он имеет огромное значение для понимания и описания химических процессов.
Примеры применения закона постоянства состава могут быть в реакциях сгорания или окисления, где масса сгорающего вещества равна массе образующихся продуктов. Например, при сгорании метана (CH4) в кислороде (O2) образуется углекислый газ (CO2) и вода (H2O), и масса метана будет равна сумме масс углекислого газа и воды, которые образуются.
Таким образом, основные принципы закона постоянства состава являются фундаментальными для понимания и описания химических реакций, и они позволяют предсказывать массу продуктов реакции на основе массы реагентов.
Химический элемент не может быть преобразован в другой элемент
В химии существует важный закон, называемый законом постоянства состава. Он утверждает, что в химической реакции масса и количество атомов веществ остаются неизменными.
Это означает, что химический элемент невозможно преобразовать в другой элемент путем химической реакции. Каждый элемент в периодической таблице имеет уникальное количество протонов в ядре своих атомов, что определяет его свойства. Химические реакции могут приводить только к изменению состава и аранжировки атомов веществ, но не к изменению элементов.
Например, при сгорании дерева происходит реакция с кислородом, в результате которой образуются углекислый газ и вода. Однако, элементы, из которых состоят углекислый газ и вода (углерод, кислород и водород), остаются неизменными. Из дерева не могут образоваться другие элементы, например, железо или алюминий.
Закон постоянства состава является основой для понимания и изучения химических реакций. Этот закон помогает химикам анализировать и прогнозировать результаты реакций, а также разрабатывать новые вещества с определенными свойствами.
Таким образом, химический элемент не может быть преобразован в другой элемент в ходе химической реакции. Это подчеркивает уникальность и постоянство каждого элемента в периодической системе, что делает химию захватывающим и интересным предметом исследования.
Химические соединения состоят из постоянного соотношения элементов
Например, вода (H2O) всегда будет содержать 2 атома водорода (H) и 1 атом кислорода (O). Независимо от того, каким способом была получена данная молекула воды, соотношение элементов всегда будет оставаться постоянным.
Этот принцип также применим к другим химическим соединениям. Например, углекислый газ (CO2) всегда будет содержать 1 атом углерода и 2 атома кислорода. Аммиак (NH3) всегда будет содержать 1 атом азота (N) и 3 атома водорода.
Закон постоянства состава позволяет химикам точно определять состав и свойства химических соединений. Это является одним из основных принципов химической науки и обеспечивает ее строгость и предсказуемость.
Примеры применения закона постоянства состава
Закон постоянства состава играет важную роль в химии и имеет множество практических применений. Рассмотрим некоторые примеры использования этого закона:
- Реакции сгорания: при сгорании вещества оно реагирует с кислородом из воздуха, и закон постоянства состава позволяет определить количество реагентов и продуктов.
- Разложение химических соединений: при разложении соединений, закон постоянства состава позволяет определить процентное содержание элементов в исходном веществе и продуктах разложения.
- Синтез новых соединений: при синтезе новых соединений по закону постоянства состава может быть определено соотношение между реагентами и продуктами.
- Анализ веществ: закон постоянства состава используется при анализе веществ и определении их состава.
- Производство химических продуктов: в промышленности закон постоянства состава позволяет оптимизировать процессы производства химических продуктов путем установления соотношения между реагентами и продуктами.
Эти примеры демонстрируют важность и широкий спектр применения закона постоянства состава в химии. Он является одним из основных принципов, на которых строится химическая наука, и его использование позволяет предсказывать и контролировать химические реакции и процессы.
Разложение воды на водород и кислород
Водород и кислород образуются в результате разложения молекул воды. Электрический ток приводит к разрыву химических связей между атомами воды, что приводит к образованию отдельных атомов водорода и кислорода. Данная реакция обратима, это означает, что водород и кислород могут снова соединяться, образуя молекулы воды.
Разложение воды на водород и кислород играет важную роль во многих процессах и приложениях. Например, это явление используется в электролизе воды, который является одним из способов производства чистого водорода. Также разложение воды используется во многих химических реакциях, таких как синтез различных соединений или в процессе сжигания.
Закон постоянства состава в химии подтверждает, что при разложении воды на водород и кислород, масса воды распределяется между продуктами реакции пропорционально их весовым соотношениям. То есть, масса водорода будет в два раза больше, чем масса кислорода, поскольку массовое соотношение воды составляет 2:1.
Образование солей при реакции кислот и оснований
Когда кислота и основание реагируют между собой, их ионные составы соединяются, образуя соль и воду. Кислота отдает один или несколько протонов (Н+) основанию, а основание отдает одну или несколько гидроксильных групп (ОН-) кислоте.
Образование соли можно представить с помощью ионной уравнения. Например, при реакции соляной кислоты (HCl) с гидроксидом натрия (NaOH), образуется хлорид натрия (NaCl) и вода:
| Реагенты | Продукты |
|---|---|
| HCl | NaCl |
| NaOH | H2O |
В результате реакции HCl и NaOH образуются ионы Na+ и Cl- из соли NaCl, а также молекулы воды H2O.
Образование солей при реакциях кислот и оснований является важным процессом в химии и имеет широкое применение. Соли используются в различных областях, таких как промышленность, медицина и пищевая промышленность.
Вопрос-ответ:
Какой закон гласит о постоянстве состава в химии?
Закон постоянства состава утверждает, что в химической реакции масса и состав исходных веществ равны массе и составу образовавшихся веществ.
Какие принципы лежат в основе закона постоянства состава?
Основные принципы закона постоянства состава в химии включают сохранение атомных ионных соединений и изменение только способов соединения атомов и ионов, а не их количества.
Можно ли дать пример закона постоянства состава в химии?
Да, в качестве примера можно привести реакцию горения метана, где метан и кислород реагируют, образуя углекислый газ и воду. В результате реакции масса и состав исходных веществ (метана и кислорода) равны массе и составу образовавшихся веществ (углекислого газа и воды).
Каким образом закон постоянства состава используется в химии?
Закон постоянства состава используется в химических расчетах и предсказании реакций. Он позволяет определить количество веществ, которое участвует в реакции, а также состав и количество образующихся веществ.
В чем практическое значение закона постоянства состава?
Практическое значение закона постоянства состава заключается в возможности предсказания и контроля процессов химических реакций. Это позволяет разрабатывать новые материалы, оптимизировать производственные процессы и повышать эффективность химических реакций.